Ping-Pong-Spiel der Elektronen und Protonen
RUB-Biophysik: Neues aus der Photosyntheseforschung
"Nature Structural Biology" berichtet über Energieumwandlung
Bochum, 24.07.2003
Pressemitteilung Nr. 237
Wenn Pflanzen Sonnenlicht in chemische Energie umwandeln, läuft in den photosynthetischen Proteinen ein kompliziertes Wechselspiel ab: Wie bei einem Ping-Pong-Spiel wandern Elektronen und Protonen abwechselnd zu ihrem Zielmolekül und nicht, wie bisher angenommen, nacheinander. Mit diesem Befund müssen die Lehrbuchkapitel über diesen Prozess umgeschrieben werden. Dr. André Remy und Prof. Dr. Klaus Gerwert (Lehrstuhl für Biophysik der RUB) berichten über ihre Forschungsergebnisse in der August-Ausgabe von "Nature Structural Biology" (NSB).
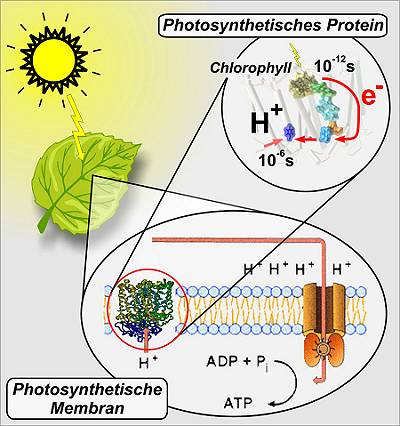
Photosynthese - Wie Pflanzen Licht in chemische Energie umwandeln
Wechselspiel zwischen Elektronen und Protonen.
|
"Stausee-Effekt" bringt Energie
Ohne Photosynthese gäbe es kein Leben auf der Erde. Durch das Sonnenlicht werden Elektronen - die Träger negativer Ladung in Atomen - aus Chlorophyllmolekülen herausgeschlagen, die einen Transport von Protonen (positiv geladene Wasserstoffteilchen) auf eine Seite der photosynthetischen Membran vermitteln. Die Protonen "stauen" sich an der Membran, wobei dann wie bei einem Stausee Energie gewonnen wird. Diese Energie nutzen molekulare "Turbinen" (die ATPasen), um den biologischen Treibstoff ATP (Adenosintriphosphat) herzustellen. Bisher wurde angenommen, dass der Prozess der Elektronen- und Protonenbewegung konsekutiv abläuft: Erst wandern die Elektronen zu ihrem Ziel, dann folgen die Protonen nach.
Ein fundamentaler Mechanismus
Remy und Gerwert hingegen konnten mit der sogenannten zeitaufgelösten FTIR (Fourier-Transform-Infrarot)-Spektroskopie zeigen, dass die Wanderungen im Photosynthese-Protein abwechselnd erfolgen. In wenigen billionstel Sekunden (Pikosekunden) steuern Elektronen den so genannten "Akzeptor" an, ihren Zielort im photosynthetischen Protein. Die negativ geladenen Teilchen ziehen positiv geladene Protonen nach, die sich in tausendstel (milli-) bis milliardstel (nano-) Sekunden bewegen. Der Protonenfluss wiederum mobilisiert den weiteren Elektronentransfer, der erneut eine Bewegung von Protonen in Gang setzt. Mit ihrer Arbeit liefern die RUB-Biophysiker neue Erkenntnisse über einen fundamentalen Mechanismus der Natur.
Modifiziertes Infrarot-Spektrometer
Die Wissenschaftler entwickelten ein spezielles FTIR-Spektrometer, um die Reaktionen der Proteingruppen mit Nanosekunden-Zeitauflösung messen zu können. Gegenstand der Messungen war das photosynthetische Reaktionszentrum, ein Protein, in dem die primären Schritte der Photosynthese ablaufen. Zur Entschlüsselung der Infrarotspektren musste das Protein molekularbiologisch verändert werden; erst der interdisziplinäre Ansatz aus physikalischen und biologischen Methoden konnte den Mechanismus klären. Eine wichtige Voraussetzung für die jetzige Arbeit war auch die Kenntnis der dreidimensionalen Raumstruktur dieses Proteins, für deren Bestimmung die Deutschen Deisenhofer, Huber und Michel 1988 mit dem Nobelpreis ausgezeichnet wurden. Komplementär hierzu erlaubt die neue Methode jetzt auch die Dynamik von Proteinen, aufbauend auf den Raumstrukturen, zu verstehen.
Weitere Informationen:
Der komplette Artikel aus Nature Structural Biology ist als PDF-Datei (756 kB) erhältlich.

