Neue Screeningmethode für potenzielle Krebswirkstoffe
RUB-Forscher finden Zwischenzustand des Ras-Proteins
Proteinoberflächenveränderung zeit- und ortsaufgelöst beobachtet
Bochum, 25.04.2007
Pressemitteilung 147/2007
Das Ras-Protein ist der zentrale Ein- und Ausschalter des Zellwachstums. Ist der Schalter defekt, läuft das Wachstum aus dem Ruder: So genanntes onkogen mutiertes Ras, das immer auf "an" geschaltet ist, ist einer der Auslöser von Krebserkrankungen. Neue Hoffnung auf gezielte Therapien macht jetzt der Fund des Forscherteams vom Lehrstuhl für Biophysik der RUB (Prof. Dr. Klaus Gerwert). Mittels eines hochauflösenden Spektroskopieverfahrens konnten die Wissenschaftler zeigen, dass das Ras-Protein zeitverzögert funktioniert. Sie wiesen erstmals einen Zustand nach, in dem das Ras-Protein zwar schon auf "an" geschaltet ist, aber noch nicht in der Lage, das Wachstumssignal weiterzugeben. "Wenn es gelingt, diesen Zustand zu stabilisieren, könnte man Krebserkrankungen aufgrund von defektem Ras an der Wurzel beheben", erklärt Prof. Gerwert. Über ihre Ergebnisse berichten die Forscher in der aktuellen Titelstory des Magazins "ChemBioChem".
Entscheidende 200 Millisekunden
Signalwege in lebenden Zellen werden über zentrale Schalterproteine reguliert. Dazu wird die Oberfläche der Proteine verändert, was die Bindung eines so genannten Effektorproteins ermöglicht und somit das Anschalten eines Signalweges bedeutet. Dem Team um Prof. Gerwert ist es nun erstmals gelungen, eine solche Oberflächenveränderung mit atomarer Auflösung in Echtzeit zu beobachten. Mittels zeitaufgelöste Infrarotspektroskopie (trFTIR) konnten sie einen Zustand identifizieren, in dem der interne Taktgeber des Schalterproteins bereits auf "an" steht, die Oberfläche sich aber erst mit einer Verzögerung von 200 Millisekunden so verändert, dass ein Effektorprotein gebunden werden kann.
Ausgangspunkt für molekulare Therapie
In onkogen mutierten Ras-Proteinen kann der interne Taktgeber nicht mehr zurückgesetzt werden und es kommt zu unkontrollierten Wachstumssignalen. Dies trägt, neben weiteren Faktoren, zur Tumorbildung bei. Der jetzt entdeckte Zustand, bei dem der interne Taktgeber auf "an" steht, die Oberfläche aber noch keine Signalweiterleitung erlaubt, kann möglicherweise als Ausgangspunkt für eine so genannte molekulare Therapie eingesetzt werden. "Bei einer molekularen Therapie wird der Tumor nicht durch Operation oder Bestrahlung, die mit erheblichen Nebenwirkungen verbunden ist, zerstört, sondern man behandelt gezielt und ursächlich den defekten Signalweg", so Prof. Gerwert. Gelingt es, mit kleinen Wirkmolekülen den neu entdeckten Zustand zwischen Einschaltung und Signalweiterleitung zu stabilisieren, kann in onkogen mutierten Ras-Proteinen die unkontrollierte Signalweiterleitung gestoppt werden.
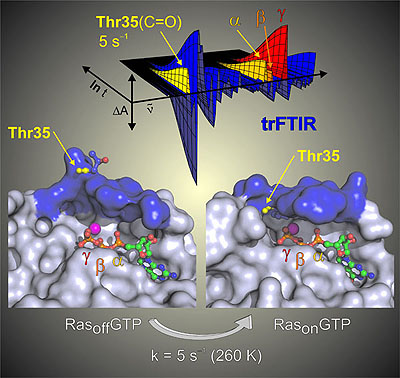
Cover ChemBioChem: Zeit- und ortsaufgelöste Messung der Oberflächenänderung des Ras-Proteins. Diese schaltet das Wachstumssignal der Zelle. In oncogen mutierten Ras Proteinen ist diese Reaktion gestört und verursacht unkontrolliertes Wachstum der Zellen.
|
Neue Wirkstoffe schell testen
In der jetzt veröffentlichten Arbeit beschreiben die Forscher einen spektroskopisch messbaren Fingerabdruck dieses Zustandes. Anhand dieses Fingerabdrucks können sie künftig sehr schnell messen, ob ein Wirkstoffe diesen Zustand stabilisieren kann und somit ein potenzielles Krebsmedikament darstellt. In Zusammenarbeit mit Pharmafirmen soll dieses Messverfahren zum schnellen Screenen von potenziellen Wirkstoffen eingesetzt werden. Die eingesetzte Technik, zeitaufgelöste Infrarotspektroskopie (trFTIR), wurde im letzten Jahr bereits mit dem "Innovationspreis Ruhr" der Alfried Krupp Stiftung und der WAZ Mediengruppe ausgezeichnet. Der Einsatz und die Weiterentwicklung der trFTIR spielt auch eine zentrale Rolle im beantragten Exzellenzcluster "Protein-Netzwerke" der RUB im Rahmen der Exzellenz-Initiative des Bundes und der Länder.
Titelaufnahme
Carsten Kötting, Klaus Gerwert, Angela Kallenbach, Yan Suveyzdis, Carolin Eichholz:
Surface Change of Ras Enabling Effector Binding Monitored in Real Time at Atomic Resolution.
In: ChemBioChem Vol. 8, No. 7/2007, p. 781-787, Doi: 10.1002/cbic.200600552
http://www3.interscience.wiley.com/cgi-bin/jabout/72510898/cover/2007_8_07.html
Weitere Informationen:
