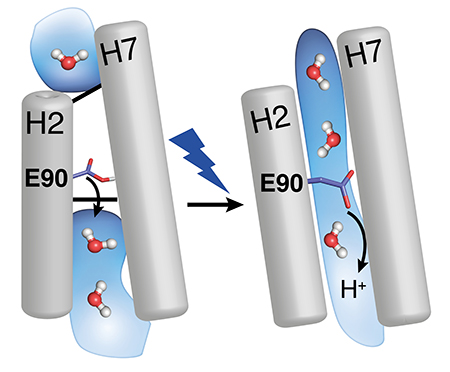
Channelrhodopsin-2 - Die Pore des Ionenkanals wird durch das Herausdrehen von Aminosäure E90 geöffnet. Wassermoleküle dringen ein, kippen Helix H2 und öffnen so den durchgängigen Kanal.
© RUB, Grafik Eisenhauer
Bochum, 07.01.2015
Presseinformation 2/2015
Mit hoher räumlicher und zeitlicher Präzision haben Forscher die Arbeitsweise des lichtgesteuerten Ionenkanals Channelrhodopsin-2 aufgeklärt. Dieses Biomolekül kommt in der Optogenetik zum Einsatz, welche es erlaubt, die Aktivität von lebenden Zellen mit Licht zu steuern. "Das von uns entwickelte Modell ermöglicht es, optogenetische Werkzeuge je nach Anwendung maßzuschneidern", sagt Prof. Dr. Klaus Gerwert vom Lehrstuhl für Biophysik der Ruhr-Universität Bochum. Gemeinsam mit Kollegen der Humboldt-Universität zu Berlin um Prof. Dr. Peter Hegemann berichten die Bochumer in der Zeitschrift "Angewandte Chemie".

Channelrhodopsin-2 - Die Pore des Ionenkanals wird durch das Herausdrehen von Aminosäure E90 geöffnet. Wassermoleküle dringen ein, kippen Helix H2 und öffnen so den durchgängigen Kanal. |
Channelrhodopsin-2 revolutionierte die Optogenetik
Das von Peter Hegemann in Grünalgen entdeckte Channelrhodopsin-2 ist das zentrale lichtaktivierbare Kanalprotein in der Optogenetik. Stattet man zum Beispiel Nervenzellen mit diesem Ionenkanal aus, kann man die Kanäle durch Lichteinstrahlung öffnen und die Zellen so aktivieren. "Die Anwendung von Channelrhodopsin-2 in der Optogenetik hat die Neurobiologie in den letzten Jahren revolutioniert", sagt Klaus Gerwert. Die Zeitschrift "Nature Methods" zeichnete das Verfahren 2010 als "Methode des Jahres" aus. "Allerdings fehlte bislang die Kenntnis darüber, was im Protein tatsächlich passiert und letztlich zu dessen Aktivierung führt", so der Bochumer Forscher weiter. Aber gerade das Verständnis der Vorgänge auf atomarer Ebene ist essenziell, um das Protein für seine Anwendung gezielt zu optimieren.
„EHT“-Modell beschreibt die Arbeitsweise von Channelrhodopsin-2
Mit zeitaufgelöster Vibrationsspektroskopie und biomolekularen Simulationen schloss das Bochumer-Berliner Team nun diese Wissenslücke. Das EHT (E90-Helix2-tilt)-Modell beschreibt die Arbeitsweise von Channelrhodopsin-2 wie folgt: Die lichtempfindliche Gruppe des Proteins, das Retinal, wird bei Lichteinfall verdrillt. Diese Verdrillung setzt sich dann im Protein fort und öffnet extrem schnell eine Pore, die im Dunkeln von der Aminosäure E90 verschlossen wird. E90 markiert die engste Stelle der Pore und öffnet diese durch Herausklappen, ähnlich der Bewegung einer Schwingtür, so dass Wasser in ein leeres Vestibül oberhalb der engsten Stelle der Pore eindringen kann. Das eindringende Wasser kippt dann die Proteinhelix H2. Das führt dazu, dass sich ein Protein durchspannender, offener Ionenkanal ausbildet. Beim Erstellen dieses Modells profitierten die Bochumer Forscher von ihren umfangreichen Erfahrungen, die sie gewannen, als sie den Mechanismus der lichtgetriebenen Protonenpumpe Bakteriorhodopsin im Detail aufklärten.
"Protein engineering": Wegbereiter für neue optogenetische Werkzeuge
"Mit diesem Strukturmodell ist nun der nächste Schritt, das protein engineering möglich", erklärt Klaus Gerwert. Durch Mutation der Aminosäure E90 lassen sich die Eigenschaften des Proteins gezielt beeinflussen. Die Leitfähigkeit oder die Selektivität für gewisse Ionen kann so auf bestimmte Anwendungen maßgeschneidert und das Protein gezielt mit verschiedenen Wellenlängen aktiviert werden.
Titelaufnahmen
J. Kuhne, K. Eisenhauer, E. Ritter, P. Hegemann, K. Gerwert, F. Bartl (2014): Early Formation of the Ion-Conducting Pore in Channelrhodopsin-2, Angewandte Chemie International Edition, DOI: 10.1002/anie.201410180
J. Kuhne, K. Eisenhauer, E. Ritter, P. Hegemann, K. Gerwert, F. Bartl (2014): Die frühe Entstehung der ionenleitenden Pore in Channelrhodopsin-2, Angewandte Chemie, DOI: 10.1002/ange.201410180
Weitere Informationen
Prof. Dr. Klaus Gerwert
Sprecher von PURE
Lehrstuhl Biophysik
Fakultät für Biologie und Biotechnologie der Ruhr-Universität
44780 Bochum
Tel. 0234/32-24461
klaus.klaus.gerwert@ruhr-uni-bochum.de
|
|